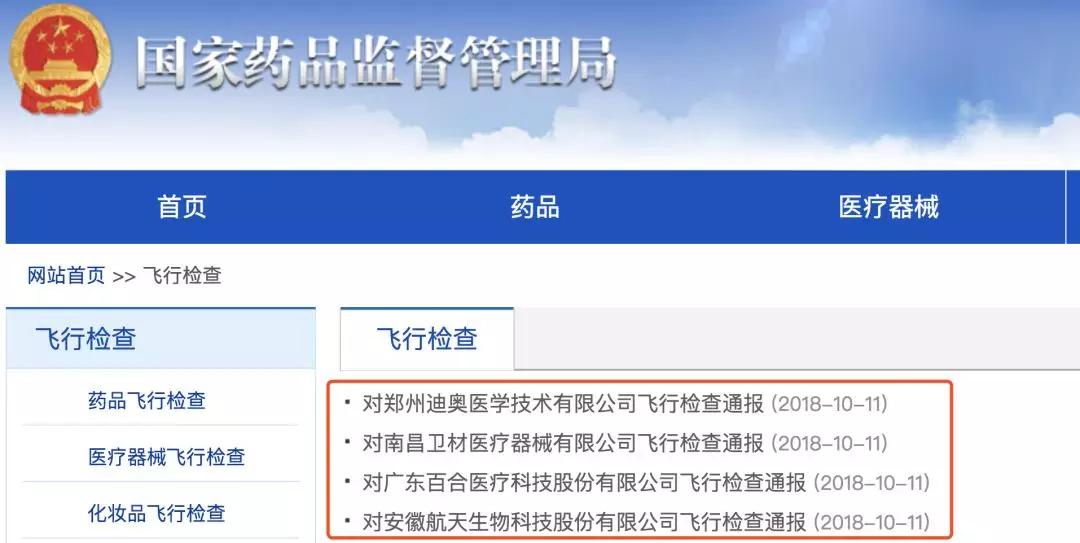
國家藥監局責令4家醫械公司全部停產!
發布時間:2018/10/12 9:25:10
4月11日,部委藥品監督管理局官方主頁披露飛檢批評通報,4家被飛檢的單位在檢修設一留存為嚴重偏差,所有停廠整治。
會根據通報批評范文,4家被飛檢的廠家依次是東莞迪奧醫美技術限制企業英文子企業廠家、東莞衛材醫院設備限制企業英文子企業廠家、東莞玫瑰醫院科持股東限制企業英文子企業廠家、河南航天高新科技怪物科持股東限制企業英文子企業廠家。